Inhaltsverzeichnis
Elemente und Atome
Die vier Elemente nach Aristoteles
Die vier klassischen Elemente sind Erde, Wasser, Luft und Feuer. Aus der Sicht des Chemikers handelt es sich hier jedoch nicht um Elemente, sondern um Gemische bzw. die Vertreter der verschiedenen Aggregatzustände und um Energie.
| Erde | Feststoffgemisch | Feste Stoffe |
|---|---|---|
| Wasser | Lösung oder Suspension oder Reinstoff | Flüssige Stoffe |
| Luft | Gasgemisch | Gasförmige Stoffe |
| Feuer | (Flamme, Rauch) | Energie |
Einteilung der Stoffe
Man unterscheidet zwischen Reinstoffen und Stoffgemischen. Immer dann, wenn die unterschiedlichen Teilchen nebeneinander vorliegen, also durch mechanische oder physikalische Methoden zu trennen sind, handelt es sich um Stoffgemische (vergleichbar mit einem Glas mit unterschiedlich gefärbten Holzkugeln).
Sind die unterschiedlichen Teilchen aber fest miteinander verbunden, so handelt es sich um eine Verbindung, also einen Reinstoff (vergleichbar mit einer Figur aus unterschiedlichen Lego-Bausteinen).
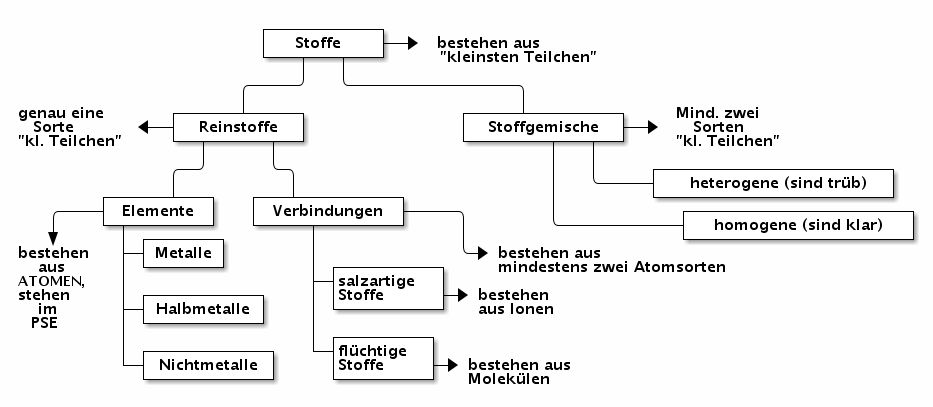
Der moderne Elementbegriff
Elemente sind Reinstoffe, die aus genau einer Sorte Teilchen, den Atomen, bestehen. Manche Elemente sind schon seit dem Altertum bekannt (z.B. Kohlenstoff, Eisen), andere wurden mit der systematischen Erforschung der Reaktionen der Stoffe im 18. Jahrhundert entdeckt (z.B. Edelgase), manche nach der Erstellung des Periodensystems durch Meyer und Mendelejew im 19. Jahrhundert gezielt gesucht, um Lücken zu füllen (z.B. Germanium). Zu Beginn des 20. Jahrhunderts erforschte und fand Marie Curie dann gezielt radioaktive Elemente (Polonium, Radium).
Auch heute noch ist man auf der Suche nach neuen (künstlichen) Elementen, die aber alle nur für den Bruchteil einer Sekunde nach ihrer Erzeugung in Teilchenbeschleunigern existieren. Hier will man zeigen, dass die Elemente mit einer Atommasse > 109 grundsätzlich existieren können. Im 21. Jh. anerkannt wurden bislang die Elemente 110 Ds, Darmstadtium, 111 Rg, Roentgenium, 112 Cn, Copernicium, 114 Fl, Flerovium und 116 Lv, Livermorium.
Elemente sortieren
Nachdem viele Elemente entdeckt waren, versuchten sowohl Meyer als auch Mendelejew Ende des 19. Jahrhunderts die Elemente zu ordnen.1)
nach Alphabet
Eine alphabetische Sortierung ist zwar für viele Listen günstig, um Worte oder Namen schnell wiederzufinden - für die Elemente gewinnt man aber keinerlei chemische Zusatzinformationen, daher ist diese Sortierung hier nicht sinnvoll.
nach Leitfähigkeit
| Nicht leitfähig | in bestimmter Form leitfähig | Halbleiter | leitfähig |
|---|---|---|---|
| Ne, Sb, Ar, Kr, He, As, P, N, Se, S, O, Br, Cl, F, H, Xe | C: Graphit (nicht leitfähig als Kohle oder Diamant) | Si (Computerchips) | Pb, Cs, Be, Li, Sr, In, Ga, Rb, Tl, Sn, Na, Li, Ca, K, Mg |
| Nichtmetalle | Halbmetall | Metalle | |
Diese Sortierung liefert schon Gruppen mit ähnlichen Eigenschaften, die Einteilung ist aber noch recht grob.
nach Siedetemperatur
He, H, Ne, N, F, Ar, O, Kr, Xe, Cl, Br, P, S, As, Cs, Se, Rb, K, Na, Mg, Li, Sr, Sb, Tl, Ca, Be, Pb, In, Ga, Al, Si, Sn, C
Diese Liste kann in drei Gruppen unterteilt werden: In Gase (He bis Cl), Flüssigkeiten (Br) und Feststoffe (P bis C). Dabei werden die Feststoffe jedoch nicht nach Metallen bzw. Nichtmetallen unterschieden.
nach Atommasse
H, He, Li, Be, C, (C und)2) N, O, F, Ne, Na, Mg, Al, Si, P, S, Cl, K, Ar und Ca, Ga, As, Se, Br, Kr, Rb, Sr, In, Sn, Sb, Xe, Cs, Tl, Pb
nach Protonenzahl
H, He, Li, Be, C, N, O, F, Ne, Na, Mg, Al, Si, P, S, Cl, Ar, K, Ca, Ga, As, Se, Br, Kr, Rb, Sr, In, Sn, Sb, Xe, Cs, Tl, Pb
Die nach Protonenzahl sortierte Liste unterscheidet sich von der nach Atommasse sortierten nur in der vertauschten Position von K und Ar.
Markiert man jetzt z.B. alle Edelgase (oben fett dargestellt), so stellt man fest, dass diese mehr oder weniger regelmäßig wieder auftauchen - Unregelmäßigkeiten liegen hier an fehlenden Elementen.
Von der Liste zur Tabelle
Notiert man die Elemente von H bis Ca geordnet nach Protonenzahl auf einem langen Streifen, wickelt diesen um eine Papierröhre auf einem Besenstiel so, dass die Edelgase untereinanderstehen, klebt die Spirale fest und schneidet dann die Papierröhre immer rechts von den Edelgasen auf, so erhält man die bekannte Tabelle des Periodensystems.
Diese Tabelle erhält man auch, wenn man immer chemisch ähnliche Elemente untereinander notiert - so waren Meyer und Mendelejew vorgegangen.

